Константа диссоциации кислоты :: Примеры расчета
Константа диссоциации кислоты · Примеры расчета · Близкие статьи ·
(A — условное обозначение аниона кислоты, [HA] — равновесная концентрация в растворе частицы НА):
Одноосновная кислота
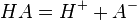
![K_{a}={\left[H^{+}\right]\left[A^{-}\right] \over \left[HA\right]}](../i/w/2cfebd43b305c3319ab4ba9f1b6a09dd.png)
Двухосновная кислота
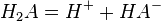
![K_{{a1}}={\left[H^{+}\right]\left[HA^{-}\right] \over \left[H_{2}A\right]}](../i/w/12265533fc558e03ecdc35794dd150ed.png)
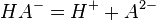
![K_{{a2}}={\left[H^{+}\right]\left[A^{{2-}}\right] \over \left[HA^{-}\right]}](../i/w/d54eff7a48495bd8d98fd172633b039f.png)
Фигурирующая в выражениях концентрация [HA] — это равновесная концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
Величина pK
Чаще вместо самой константы диссоциации K используют величину pK, которая определяется как отрицательный десятичный логарифм самой константы:
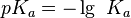 .
.