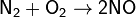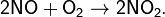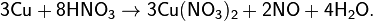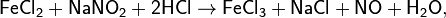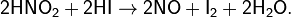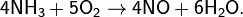Оксид азота(II) :: Получение
Оксид азота(II) · Получение · Химические свойства · Физиологическое действие · Применение · Близкие статьи · Примечания ·
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах (тепловой эффект реакции 180,9 кДж):
и тотчас же реагирует с кислородом:
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, к примеру, с медью:
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):