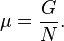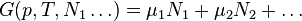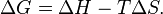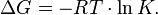Энергия Гиббса :: Применение в химии
Энергия Гиббса · Определение · Связь с термодинамической устойчивостью системы · Применение в химии · Историческая справка · Литература · Близкие статьи ·
Связь с химическим потенциалом
Используя свойства экстенсивности термодинамических потенциалов, математическим следствием которых является соотношение Гиббса-Дюгема, можно показать, что химический потенциал для системы с одним типом частиц есть отношение энергии Гиббса к числу частиц в системе:
Если система состоит из частиц нескольких сортов 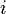 с числом
с числом 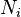 частиц каждого сорта, то соотношения Гиббса-Дюгема приводят к выражению
частиц каждого сорта, то соотношения Гиббса-Дюгема приводят к выражению
Химический потенциал используется при анализе систем с переменным числом частиц, и кроме этого при изучении фазовых переходов. Так, исходя из соотношений Гиббса-Дюгема и из условий равенства химических потенциалов 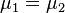 находящихся в равновесии друг с другом фаз, можно получить уравнение Клапейрона-Клаузиуса, опрделяющее линию сосуществования двух фаз в координатах
находящихся в равновесии друг с другом фаз, можно получить уравнение Клапейрона-Клаузиуса, опрделяющее линию сосуществования двух фаз в координатах 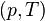 через термодинамические параметры (удельные объёмы) фаз и теплоту перехода между фазами.
через термодинамические параметры (удельные объёмы) фаз и теплоту перехода между фазами.
Энергия Гиббса и направление протекания реакции
В химических процессах одновременно действуют два противоположных фактора — энтропийный (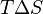 ) и энтальпийный (
) и энтальпийный (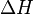 ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (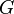 ):
):
Из этого выражения следует, что 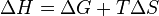 , то есть некоторое количество теплоты расходуется на увеличение энтропии (
, то есть некоторое количество теплоты расходуется на увеличение энтропии (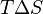 ), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её зачастую называют связанной энергией. Другая часть теплоты (
), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её зачастую называют связанной энергией. Другая часть теплоты (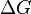 ) может быть использована для совершения работы, поэтому энергию Гиббса зачастую называют также свободной энергией.
) может быть использована для совершения работы, поэтому энергию Гиббса зачастую называют также свободной энергией.
Характер изменения энергии Гиббса даёт возможность судить о принципиальной возможности осуществления процесса. При 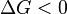 процесс может протекать, при
процесс может протекать, при 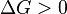 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же 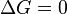 , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства 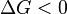 (по кинетическим причинам).
(по кинетическим причинам).
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса 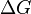 в ходе химической реакции с её константой равновесия
в ходе химической реакции с её константой равновесия 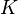 :
:
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). Помимо этого константа равновесия определяется как
где 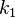 — константа скорости прямой реакции,
— константа скорости прямой реакции, 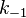 — константа скорости обратной реакции.
— константа скорости обратной реакции.