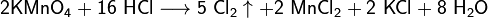Соляная кислота :: Химические свойства
Соляная кислота · Физические свойства · Химические свойства · Производство · Применение · Особенности обращения · Примечания · Официальный сайт ·
- Взаимодействие с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода:
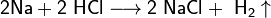
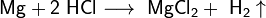
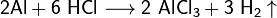
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
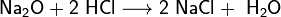
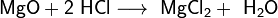
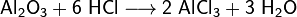
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
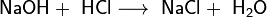
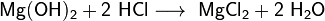
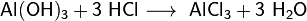
- Взаимодействие с солями металлов, образованных более слабыми кислотами, к примеру угольной:
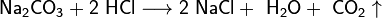
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора: