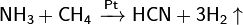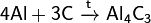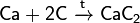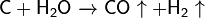Углерод :: Химические свойства
Углерод · История · Физические свойства · Аллотропные модификации углерода · Нахождение в природе · Химические свойства · Применение · Токсическое действие · Близкие статьи · Комментарии · Примечания · Литература · Официальный сайт ·
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах следовательно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4 (напр., CO2), 4 (напр., CH4), редко +2 (СО, карбонилы металлов), +3 (C2N2); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С0 к С4+ следовательно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует со многими элементами. Соединения с неметаллами имеют свои собственные названия — метан, тетрафторметан.
Продукты горения углерода в кислороде являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). Известен также неустойчивый недооксид углерода С3О2 (температура плавления 111 °C, температура кипения 7 °C) и некоторые другие оксиды (к примеру C12O9, C5O2, C12O12). Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C.
Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты. На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. С большинством металлов углерод образует карбиды, к примеру:
Важна в промышленности реакция углерода с водяным паром:
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности.
Органические соединения
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Соединения углерода составляют основу земной жизни, а их свойства в большей части определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.