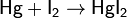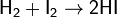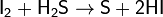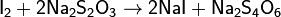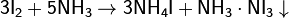Иод :: Химические свойства
Иод · Название и обозначение · История · Нахождение в природе · Физические свойства · Химические свойства · Изотопы · Применение · Биологическая роль · Близкие статьи · Примечания · Официальный сайт ·
Иод относится к группе галогенов.
Электронная формула (Электронная конфигурация) иода: 1s22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO2), иодноватую (HIO3), иодную (HIO4).
Химически иод довольно активен, не смотря на то, что и в меньшей степени, чем хлор и бром.
- С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
- С водородом иод реагирует только при нагревании и не полностью, образуя иодоводород:
- Иод является окислителем менее сильным, чем фтор, хлор и бром. Сероводород H2S , Na2S2O3 и прочие восстановители восстанавливают его до иона I:
Последняя реакция используется в аналитической химии для определения йода.
- При растворении в воде иод частично реагирует с ней:
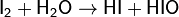 pKc=15.99
pKc=15.99
Реакция образования нитрида трииода: