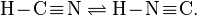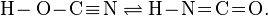Таутомерия
Таутомерия · Литература ·
Таутомерия (от греческий — тот же самый и — мера) — явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. Помимо этого устанавливается таутомерное равновесие, и вещество одновременно содержит молекулы всех изомеров (таутомеров) в определённом соотношении.
Зачастую при таутомеризации происходит перемещение атомов водорода от одного атома в молекуле к другому и обратно в одном и том же соединении. Классическим примером является ацетоуксусный эфир, представлющий собой равновесную смесь этилового эфира ацетоуксусной (I) и оксикротоновой кислот (II).
Таутомерия сильно проявляется для целого круга веществ, производных циановодорода. Так уже сама синильная кислота существует в двух таутомерных формах:
При комнатной температуре равновесие превращения циановодорода в изоциановодород смещено влево. Показано, что не так стабильный изоциановодород более токсичен.
Аналогичное превращение известно для циановой кислоты, которая известна в трёх изомерных формах, в тоже время таутомерное равновесие связывает только две из них: циановую и изоциановую кислоты:
Для обеих таутомерных форм известны сложные эфиры, т. е. продукты замещения в циановой кислоте водорода на углеводородные радикалы. В отличие от указанных таутомеров третий изомер – гремучая (фульминовая) кислота не способна к самопроизвольному превращению в другие формы.
С явлением таутомерии связаны многие химико-технологические процессы, особенно в области синтеза лекарственных веществ и красителей (производство витамина С — аскорбиновой кислоты в др.). Очень важна роль таутомерии в процессах, протекающих в живых организмах.
Амид-иминольную таутомерию лактамов называют лактам-лактимной таутомерией. Она играет большую роль в химии гетероциклических соединений. Равновесие в большинстве случаев смещено в сторону лактамной формы.