Цвиттер-ион
Цвиттер-ион · Примеры · Примечания ·
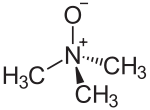
Цвиттер-ион (биполярный ион; нем. Zwitter — гибрид) — молекула, которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды, локализованные на несоседних атомах. К цвитер-ионным соединениям зачастую относят и внутримолекулярные соли (к примеру, внутримолекулярные соли аминокислот) и, в некоторых случаях, ионные диполярные соединения, в том числе и с зарядами на соседних атомах (к примеру, N-оксиды аминов). Цвиттер-ионные соединения высокополярны и поэтому, обычно, обладают хорошей растворимостью в полярных растворителях (воде, диметилсульфоксиде и т. п.) и слабой — в большинстве органических неполярных растворителей.
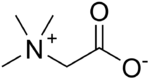
Одним из наиболее широких классов цвитер-ионных соединений являются бетаины — соединения, в которых содержатся положительно заряженная ониевая группа и анионная группировка, разделенные одним или несколькими атомами, среди которых есть как природные соединения, содержащие четвертичную аммонийную группу (N,N,N-триметиламиноглицинат — бетаин, тригонеллин — бетаин N-метилникотиновой кислоты и др.), так и фосфониевые и сульфониевые бетаины.
Особым классом бетаинов являются гетероциклические мезоионные соединения — сидноны и мюнхоны, в которых заряды делокализованы таким образом, что в наборе мезомерных структур присутствуют как структуры с зарядами на соседних так и на несоседствующих атомах:
-
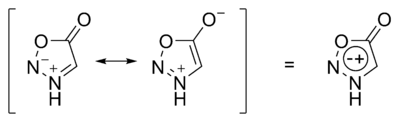
- Сидноны
-
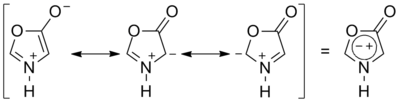
- Мюнхоны
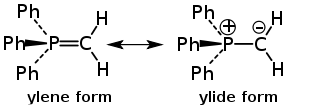
К цвиттер-ионным соединениям также относят илиды — 1,2-диполярные соединения, в которых отрицательный заряд локализован на атоме углерода, а положительный — на соседнем гетероатоме, обычно атоме азота (илиды аммониевых солей), фосфора либо серы (илиды фосфония и сульфония). Илиды аммония имеют полностью цвиттер-ионный характер с одинарной связью между атомами с различными зарядами, в случае илидов фосфония и сульфония вследствие участия d-орбиталей гетероатома связь принимает частично двойной характер и структура таких илидов описывается резонансом между иленовой и илидной формами:
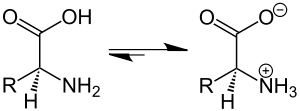
Амфолиты — это молекулы, в структуре которых присутствуют как кислотные, так и основные группы, существующие в виде цвиттер-ионов при определённых значених pH. Этот pH обозначается как изоэлектрическая точка молекулы. Амфолиты образуют растворы с хорошими буферными свойствами. Благодаря способности к выборочной ионизации они противодействуют изменению pH при добавлении кислоты или основания. В присутствии кислот они принимают на себя протоны, удаляя последние из раствора, и противодействуют повышению его кислотности. При добавлении оснований амфолиты высвобождают ионы водорода в раствор, препятствуя возрастанию pH, и тем сохраняя его равновесие.