Белки :: Жизненный цикл
Белки · История изучения · Свойства · Структура · Синтез · Посттрансляционная модификация · Жизненный цикл · Функции белков в организме · Белки в обмене веществ · Методы изучения · Близкие статьи ·
Внутриклеточный транспорт и сортировка
Подробнее: Внутриклеточная сортировка белков
Синтезируемые в цитоплазме эукариотической клетки белки обязаны транспортироваться в разные органоиды клетки: ядро, митохондрии, эндоплазматический ретикулум (ЭПР), аппарат Гольджи, лизосомы и др., а некоторые белки обязаны попасть во внеклеточную среду. Для попадания в определённый отдел клетки белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или сигнальная последовательность белка), но в некоторых случаях меткой служат посттрансляционно присоединённые к белку олигосахариды.
Транспорт белков в ЭПР осуществляется по мере их синтеза, поскольку рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные белки на его внешней мембране. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы и на внешнюю мембрану или во внеклеточную среду белки попадают путём везикулярного транспорта. В ядро белки, обладающие сигналом ядерной локализации, попадают через ядерные поры. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шаперонов.
Поддержание структуры и деградация
Поддержание правильной пространственной структуры белков принципиально для их нормального функционирования. Неправильное сворачивание белков, приводящее к их агрегации, может быть вызвано мутациями, окислением, стрессовыми условиями или глобальными изменениями в физиологии клетки. Агрегация белков является характерным признаком старения организма. Считается, что неправильный фолдинг белков является причиной или усугубляет такие заболевания, как муковисцидоз, лизосомная болезнь накопления , и кроме этого нейродегенеративные расстройства (болезни Альцгеймера, Хантингтона и Паркинсона).
В процессе эволюции клетками было выработано четыре основных механизма для противодействия агрегации белков. Первые два — повторное сворачивание (рефолдинг) с помощью шаперонов и расщепление протеазами — встречаются как у бактерий, так и у высших организмов. Аутофагия и накопление неправильно свёрнутых белков в особых немембранных органеллах характерны для эукариотов.
Шапероны
Подробнее: Шапероны
Способность белков восстанавливать правильную трёхмерную структуру после денатурации позволила выдвинуть гипотезу о том, что вся информация о конечной структуре белка содержится в его аминокислотной последовательности. Сегодня общепризнана теория о том, что стабильная конформация белка обладает минимальной свободной энергией по сравнению с другими возможными конформациями этого полипептида.
В клетках существует группа белков, функция которых — обеспечение правильного сворачивания других белков после их синтеза на рибосоме, восстановление структуры белков после их повреждения, и кроме этого создание и диссоциация белковых комплексов. Эти белки называются шаперонами. Концентрация многих шаперонов в клетке возрастает при резком повышении температуры окружающей среды, поэтому они относятся к группе Hsp (англ. heat shock proteins — белки теплового шока). Важность нормальной работы шаперонов для функционирования организма может быть проиллюстрирована на примере шаперона -кристаллина, входящего в состав хрусталика глаза человека. Мутации в этом белке приводят к помутнению хрусталика из-за агрегирования белков и, как результат, к катаракте.
Протеолиз
Подробнее: Протеолиз, Протеасома
Если третичная структура белков не может быть восстановлена, они разрушаются клеткой. Ферменты, осуществляющие деградацию белков, называются протеазами. По месту атаки молекулы субстрата протеолитические ферменты делятся на эндопептидазы и экзопептидазы:
- Эндопептидазы, или протеиназы, расщепляют пептидные связи внутри пептидной цепи. Они узнают и связывают короткие пептидные последовательности субстратов и относительно специфично гидролизуют связи между определёнными аминокислотными остатками.
- Экзопептидазы гидролизуют пептиды с концов цепи: аминопептидазы — с N-конца, карбоксипептидазы — с С-конца. И наконец, дипептидазы расщепляют только дипептиды.
По механизму катализа Международный союз по биохимии и молекулярной биологии выделяет несколько классов протеаз, среди них сериновые протеазы, аспарагиновые протеазы, цистеиновые протеазы и металлопротеазы.
Особый тип протеазы — Протеасома, крупная мультисубъединичная протеаза, присутствующая в ядре и в цитоплазме эукариот, архей и некоторых бактерий.
Для того, чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для лигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени. В целом, эта система получила название убиквитин-зависимой деградации белка. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы.
Деградация белка в пероксисомах важна для протекания многих клеточных процессов, включая клеточный цикл, регуляцию экспрессии генов и ответ на окислительный стресс.
Аутофагия
Подробнее: Аутофагия
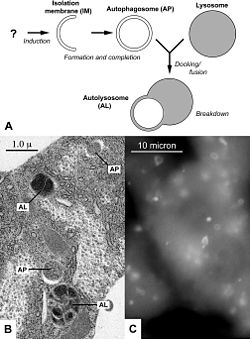
Аутофагия — это процесс деградации долгоживущих биомолекул, в частности, белков, а также органелл в лизосомах (у млекопитающих) или вакуолях (у дрожжей). Аутофагия сопровождает жизнедеятельность любой нормальной клетки, но стимулами к усилению процессов аутофагии в клетках могут служить нехватка питательных веществ, наличие в цитоплазме повреждённых органелл и, и наконец, наличие в цитоплазме частично денатурированных белков и их агрегатов.
Различают три типа аутофагии: микроаутофагию, макроаутофагию и шаперон-зависимую аутофагию.
При микроаутофагии макромолекулы и обломки клеточных мембран захватываются лизосомой. Таким путём клетка может переваривать белки при нехватке энергии или строительного материала (к примеру, при голодании). Но процессы микроаутофагии происходят и при нормальных условиях и в целом неизбирательны. В некоторых случаях в ходе микроаутофагии перевариваются и органоиды; так, у дрожжей описана микроаутофагия пероксисом и частичная микроаутофагия ядер, при которой клетка сохраняет жизнеспособность.
При макроаутофагии участок цитоплазмы (зачастую содержащий какие-либо органоиды) окружается мембранным компартментом, похожим на цистерну эндоплазматического ретикулума. В результате этот участок отделяется от остальной цитоплазмы двумя мембранами. Такие двухмембранные органеллы называются аутофагосомами. Аутофагосомы сливаются с лизосомами, образуя аутофаголизосомы, в которых органеллы и остальное содержимое аутофагосом перевариваются. Видимо, макроаутофагия также неизбирательна, не смотря на то, что зачастую подчёркивается, что с помощью неё клетка может избавляться от «отслуживших свой срок» органоидов (митохондрий, рибосом и др.).
Третий тип аутофагии — шаперон-зависимая. Помимо этого способе происходит направленный транспорт частично денатурированных белков из цитоплазмы сквозь мембрану лизосомы в её полость, где они перевариваются. Этот тип аутофагии, описанный только у млекопитающих, индуцируется стрессом.
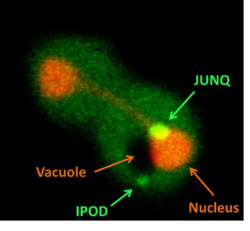
JUNQ и IPOD
В условиях стресса, когда эукариотическая клетка не может справиться с накоплением большого числа денатурированных белков, они могут направляться в один из двух типов временных органелл — JUNQ и IPOD .
JUNQ (англ. JUxta Nuclear Quality control compartment — околоядерный компартмент контроля качества белков) ассоциирован с внешней стороной ядерной мембраны и содержит убиквитинированные белки, которые могут быстро переходить в цитоплазму, а также шапероны и протеасомы. Предполагаемая функция JUNQ состоит в рефолдинге и/или деградации белков.
IPOD (англ. Insoluble Protein Deposit — место отложения нерастворимых белков) расположен около центральной вакуоли и содержит неподвижные агрегаты фомирующих амилоиды белков. Накопление этих белков в IPOD может предотвращать их взаимодействие с нормальными клеточными структурами, поэтому предполагают, что это включение имеет защитную функцию.