Белки :: Методы изучения
Белки · История изучения · Свойства · Структура · Синтез · Посттрансляционная модификация · Жизненный цикл · Функции белков в организме · Белки в обмене веществ · Методы изучения · Близкие статьи ·
Структуру и функции белков изучают как на очищенных препаратах in vitro, так и в их естественном окружении в живом организме, in vivo. Исследования чистых белков в контролируемых условиях полезны для определения их функций: кинетических особенностей каталитической активности ферментов, относительного сродства к различным субстратам и т. п. Исследования белков in vivo в клетках или в целых организмах предоставляют дополнительную информацию о том, где они функционируют и как регулируется их активность.
Молекулярной и клеточной биологии
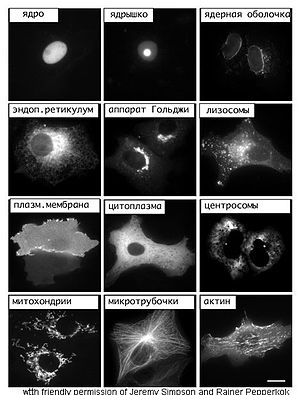
Методы молекулярной и клеточной биологии обычно применяются для изучения синтеза и локализации белков в клетке. Широко используется метод изучения локализации, основанный на синтезе в клетке химерного белка, состоящего из исследуемого белка, соединённого с «репортёром», к примеру, зелёным флуоресцентным белком (GFP). Расположение такого белка в клетке можно увидеть с помощью флуоресцентного микроскопа. Кроме того, белки можно визуализировать с помощью распознающих их антител, которые в свою очередь несут флуоресцентную метку. Зачастую одновременно с изучаемым белком визуализируют известные белки таких органелл, как эндоплазматический ретикулум, аппарат Гольджи, лизосомы и вакуоли, что позводяет более точно определить локализацию изучаемого белка.
Иммуногистохимические методы обычно используют антитела, которые коньюгированы с ферментами, катализирующими реакцию образования люминесцирующего или окрашенного продукта, что даёт возможность сравнить локализацию и количество изучаемого белка в образцах. Более редкой методикой определения расположения белков является равновесное ультрацентрифугирование клеточных фракций в градиенте сахарозы или хлорида цезия.
И наконец, один из классических методов — это иммуноэлектронная микроскопия, которая принципиально похожа на иммунофлуоресцентную микроскопию с тем отличием, что используется электронный микроскоп. Образец подготавливается для электронной микроскопии, а после обрабатывается антителами к белку, которые соединены с электронно-плотным материалом, как правило, золотом.
С помощью сайт-направленного мутагенеза исследователи могут изменять аминокислотную последовательность белка и, следовательно, его пространственную структуру, расположение в клетке и регуляцию его активности. С помощью этого метода, используя модифицированные тРНК, можно также ввести в белок искусственные аминокислоты, и сконструировать белки с новыми свойствами.
Биохимические

Для выполнения анализа in vitro белок должен быть очищен от других клеточных компонентов. Этот процесс обычно начинается с разрушения клеток и получения так называемого клеточного экстракта. Далее методами центрифугирования и ультрацентрифугирования этот экстракт может быть разделён на фракции, содержащие:
растворимые белки;
мембранные липиды и белки;
клеточные органеллы и нуклеиновые кислоты.
Осаждение белков методом высаливания используется для разделения белковых смесей, и кроме этого даёт возможность сконцентрировать белки. Седиментационный анализ (центрифугирование) позволяет фракционировать белковые смеси по значению константы седиментации отдельных белков, измеряемой в сведбергах (S). Чтобы выделить необходимый белок или белки на основе таких свойств, как молекулярная масса, заряд и аффинность, после используются различные виды хроматографии. Кроме того, белки могут быть выделены в соответствии с их зарядом с использованием электрофокусирования.
Чтобы упростить процесс очистки белков, зачастую используется генетическая инженерия, которая позволяет создать производные белков, удобные для очистки, не затрагивая их структуры или активности. «Метки», представляющие собой небольшие аминокислотные последовательности, к примеру, цепочку из 6 и более остатков гистидина, и прикрепляются к одному из концов белка. Когда экстракт клеток, синтезировавших «меченнный» белок пропускается через хроматографическую колонку, содержащую ионы никеля, гистидин связывается никелем и остается на колонке, в то время как остальные компоненты лизата беспрепятственно проходят сквозь колонку (никель-хелатная хроматография). Множество других меток было разработано, чтобы помочь исследователям выделить специфические белки из сложных смесей зачастую методом аффинной хроматографии.
Степень очистки белка можно определить, если известны его молекулярная масса и изоэлектрическая точка — с помощью различных видов гель-электрофореза — или измерения ферментативной активности, если белок является ферментом. Масс-спектрометия позволяет идентифицировать выделенный белок по его молекулярной массе и массе его фрагментов.
Для определения количества белка в образце используют ряд методик:
биуретовый метод;
микробиуретовый метод;
метод Бредфорда;
метод Лоури;
спектрофотометрический метод.
Протеомика
Подробнее: Протеомика
Совокупность белков клетки называется протеомом, его изучение — протеомикой, названной по аналогии с геномикой. Основные экспериментальные методы протеомики включают:
- 2D-электрофорез, который позволяет разделять многокомпонентные белковые смеси;
- масс-спектрометрию, которая позволяет идентифицировать белки по массе составляющих их пептидов с высокой пропускной способностью;
- белковые микрочипы, которые дают возможность одновременно измерять содержание большого количества белков в клетке;
- дрожжевую двугибридную систему , которая позволяет систематически изучать белок-белковые взаимодействия.
Совокупность всех биологически значимых взаимодействий белков в клетке называется интерактомом. Систематическое исследование структуры белков, представляющих все возможные типы третичных структур, называется структурной геномикой.
Предсказание структуры и моделирование
Подробнее: Предсказание структуры белка
Предсказание пространственной структуры с помощью компьютерных программ (in silico) позволяется строить модели белков, структура которых еще не определена экспериментально. Самый успешный тип предсказания структур, известный как гомологическое моделирование, опирается на существующую «шаблонную» структуру, сходную по аминокислотной последовательности с моделируемым белком. Методы предсказания пространственной структуры белков используются в развивающейся области генетической инженерии белков, с помощью которой уже получены новые третичные структуры белков. Более сложной вычислительной задачей является прогнозирование межмолекулярных взаимодействий, таких как молекулярная стыковка и предсказание белок-белковых взаимодействий.
Фолдинг и межмолекулярные взаимодействия белков могут быть смоделированы с использованием молекулярной механики , в частности, молекулярной динамики и метода Монте-Карло, которые всё чаще используют преимущества параллельных и распределенных вычислений (например, проект Folding@home). Фолдинг небольших -спиральных белковых доменов, например, белка виллина или одного из белков ВИЧ, были успешно смоделированы in silico. С помощью гибридных методов, сочетающих стандартную молекулярную динамику с квантовой механикой, были исследованы электронные состояния зрительного пигмента родопсина.