Основание (химия) :: Определение основания
Основание (химия) · Определение основания · Сила оснований · Близкие статьи · Комментарии · Примечания ·
Развитие понятия основания
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (к примеру, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что такие вещества служат «основаниями» для образования солей в твёрдой форме.
Единая теория кислот и оснований была впервые представлена шведским физикохимиком С. Аррениусом в 1887 году. В рамках своей теории Аррениус определял кислоту как вещество, при диссоциации которого образуются протоны H+, а основание — как вещество, дающее при диссоциации гидроксид-ионы OH-. Теория Аррениуса, в тоже время имела свои недостатки, к примеру, она не учитывала влияние растворителя на кислотно-основное равновесие, и кроме этого была неприменима к неводным растворам.
В 1924 году Э. Франклином была создана сольвентная теория, согласно которой основание определялось как соединение, которое при диссоциации увеличивает число тех же анионов, которые образуются при диссоциации растворителя.
С 1923 года основание стали определять в рамках теорий Брёнстеда — Лоури и Льюиса, которые широко применяются и сегодня.
Основание в теории Брёнстеда — Лоури
В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Й. Брёнстедом и английским учёным Т. Лоури, основанием Брёнстеда называется соединение или ион, способный принимать (отщеплять) протон от кислоты. Следовательно, кислота Брёнстеда является донором протонов, а взаимодействие кислоты с основанием сводится к передаче протона. При реакции основания Брёнстеда B с кислотой, например, с водой, основание превращается в сопряжённую кислоту BH+, а кислота становится сопряжённым основанием:
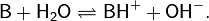
Основание в теории Льюиса
Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Льюисом, основание — это вещество, способное отдавать электронную пару на образование связи с кислотой Льюиса. Основаниями Льюиса могут быть амины R3N, спирты ROH, простые эфиры ROR, тиолы RSH, тиоэфиры RSR, анионы, соединения с -связями. Исходя из орбитали, на которой расположена участвующая в реакции пара электронов, основания Льюиса подразделяют на n-, - и -типы — электронные пары для этих типов расположены следовательно на несвязывающих, - и -орбиталях.
Понятия основания в теориях Льюиса и Брёнстеда — Лоури совпадают: согласно обеим теориям основания отдают пару электронов на образование связи. Разница заключается лишь в том, куда расходуется эта электронная пара. Основания Брёнстеда за её счёт образуют связь с протоном, а основания Льюиса — с любыми частицами, имеющими вакантную орбиталь. Таким образом, существенные различия этих теорий касаются понятия кислоты, а не основания.
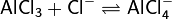
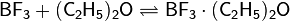
Теория Льюиса не предусматривает количественной оценки способности оснований реагировать с кислотами Льюиса. В тоже время, для качественной оценки широко используется принцип жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО), согласно которому жёсткие кислоты предпочтительно реагируют с жёсткими основаниями, а мягкие кислоты — с мягкими основаниями. По Пирсону, жёсткими основаниями являются основания, донорный центр которых обладает низкой поляризуемостью и высокой электроотрицательностью. Напротив, мягкими основаниями являются донорные частицы с высокой поляризуемостью и низкой электроотрицательностью. Жёсткие и мягкие кислоты обладают такими же свойствами как жёсткие и мягкие основания следовательно с той разницей, что они являются акцепторными частицами.
Критерий ЖКМО не имеет количественных параметров, в тоже время основания Льюиса можно приблизительно расположить в ряды по их льюисовской основности. К примеру, мягкость оснований убывает в следующих рядах:
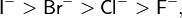
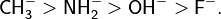
Основание в общей теории Усановича
В общей теории кислот и оснований, созданной М. И. Усановичем в 1939 году, основание определено как вещество, отдающее анионы (или электроны) и принимающие катионы. Таким образом, в рамках теории Усановича в понятие основания входят как основания Брёнстеда, так и основания Льюиса, и кроме этого восстановители. Кроме того, само понятие основности, как и кислотности, в общей теории Усановича рассматривается как функция вещества, проявление которой зависит не от самого вещества, а от его партнёра по реакции.