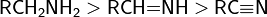Основание (химия) :: Сила оснований
Основание (химия) · Определение основания · Сила оснований · Близкие статьи · Комментарии · Примечания ·
Количественное описание силы оснований
Теория Брёнстеда — Лоури даёт возможность количественно оценить силу оснований, то есть их способность отщеплять протон от кислот. Это принято делать при помощи константы основности Kb — константы равновесия реакции основания с кислотой сравнения, в качестве которой выбрана вода. Чем выше константа основности, тем выше сила основания и тем больше его способность отщеплять протон. Зачастую константу основности выражают в виде показателя константы основности pKb. К примеру, для аммиака как основания Брёнстеда можно записать:
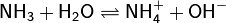
![K_{b}={\frac {[{\mathsf {NH_{4}^{+}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {NH_{3}}}]}}=1{,}79\cdot 10^{{-5}};](../i/w/f2bdfa5e97b96129a4057e978420be53.png)
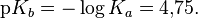
Для многоосновных оснований используют несколько значений констант диссоциации Kb1, Kb2 и т. д. Например, фосфат-ион может протонироваться трижды:
![{\mathsf {PO_{4}^{{3-}}+H_{2}O}}\rightleftharpoons {\mathsf {HPO_{4}^{{2-}}+OH^{-}}};K_{{\mathrm {b1}}}={\frac {[{\mathsf {HPO_{4}^{{2-}}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {PO_{4}^{{3-}}}}]}}=2{,}10\cdot 10^{{-2}};](../i/w/2b3b36db376dae32e5fd7d815bd6f4a7.png)
![{\mathsf {HPO_{4}^{{2-}}+H_{2}O}}\rightleftharpoons {\mathsf {H_{2}PO_{4}^{-}+OH^{-}}};K_{{\mathrm {b2}}}={\frac {[{\mathsf {H_{2}PO_{4}^{-}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {HPO_{4}^{{2-}}}}]}}=1{,}58\cdot 10^{{-7}};](../i/w/85580279c00d58e5b1c4e17985b17885.png)
![{\mathsf {H_{2}PO_{4}^{-}+H_{2}O}}\rightleftharpoons {\mathsf {H_{3}PO_{4}+OH^{-}}};K_{{\mathrm {b3}}}={\frac {[{\mathsf {H_{3}PO_{4}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {H_{2}PO_{4}^{-}}}]}}=1{,}32\cdot 10^{{-12}}.](../i/w/b273537463551608eec689b19b257212.png)
Силу основания можно также охарактеризовать константой кислотности его сопряжённой кислоты Ka (BH+), причём произведение константы основности Kb на константу Ka (BH+) равно ионному произведению воды для водных растворов и константе автопротолиза растворителя в общем случае.
![K_{a}{\mathrm {(NH_{4}^{+})}}={\frac {[{\mathsf {NH_{3}}}]\cdot [{\mathsf {H^{+}}}]}{[{\mathsf {NH_{4}^{+}}}]}}=5{,}62\cdot 10^{{-10}};](../i/w/2a2dfafd006e65c93f69f9f103a92f5b.png)
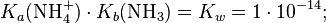
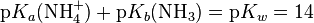
Из последнего уравнения также следует, что сила основания тем выше, чем ниже кислотность сопряжённой ему кислоты. Например, вода является слабой кислотой и при отщеплении протона превращается в сильное основание — гидроксид-ион OH-.
Значения pKb некоторых оснований и pKa их сопряжённых кислот в разбавленных водных растворах
Влияние растворителя
На кислотно-основное равновесие значительное влияние оказывает растворитель. В частности, для водных растворов было найдено, что все основания с константами основности pKb < 0 имеют одинаковые свойства (к примеру, pH растворов). Объясняется это тем, что такие основания в воде практически нацело превращаются в гидроксид-ион OH–, который является единственным основанием в растворе. Так, все основания с pKb < 0 (амид натрия NaNH2, гидрид натрия NaH и др.) дают эквивалентное количество гидроксид-ионов в водных растворах, выравниваясь между собой по силе. Данное явление получило название нивелирующего эффекта растворителя. Аналогичным образом, в водных растворах выравниваются по силе и очень слабые основания с pKb > 14.
Основания с pKb от 0 до 14 в воде частично протонированы и находятся в равновесии с сопряжённой кислотой, а их свойства в растворе зависят от значения pKb. В этом случае говорят о дифференцирующем эффекте растворителя. Интервал pKb, в котором основания дифференцированы по силе, равен показателю константы автопротолиза растворителя. Для разных растворителей этот интервал различен (14 для воды, 19 для этанола, 33 для аммиака и т. д.), следовательно, и набор дифференцированных и нивелированных оснований для них разный.
В растворителях, обладающих выраженными кислотными свойствами, все основания становятся более сильными и большее число оснований нивелируется по силе. Например, уксусная кислота уравнивает большая часть известных оснований по силе, со своим сопряжённым основанием — ацетат-ионом CH3COO–. Напротив, основные растворители (аммиак) служат дифференцирующими растворителями для оснований.
Влияние строения основания
Существует несколько факторов, которые определяют относительную силу органических и неорганических оснований и которые связаны с их строением. Часто несколько факторов действуют одновременно, поэтому трудно предсказать их суммарное влияние. Среди наиболее значимых можно выделить следующие факторы.
- Индуктивный эффект (эффект поля). При повышении доступности электронной пары основания его сила возрастает. По этой причине введение электронодонорных заместителей в основание способствует проявлению им основных свойств. Например, введение алкильных заместителей в молекулу аммиака приводит к более сильным основаниям, чем сам аммиак. Напротив, введение акцепторных заместителей в молекулу понижает силу основания.
| аммиак NH3 |
Метиламин CH3NH2 |
Этиламин C2H5NH2 |
Диметиламин (CH3)2NH |
Диэтиламин (C2H5)2NH |
Триметиламин (CH3)3N |
Триэтиламин (C2H5)3N |
|---|---|---|---|---|---|---|
| 4,75 | 3,36 | 3,33 | 3,23 | 3,07 | 4,20 | 3,12 |
- Мезомерный эффект (резонансный эффект). Электронодонорные и электроноакцепторные заместители оказывают положительное и отрицательное влияние на силу основания следовательно также через систему сопряжения. В таком случае говорят о мезомерном эффекте. Этот эффект приводит к тем же последствиям, что и индуктивный: различается лишь механизм их действия. Так, пара-нитроанилин является более слабым основанием, чем анилин (pKb равны 12,89 и 9,40 соответственно) из-за акцепторного влияния нитрогруппы, которая снижает доступность электронной пары азота аминогруппы.
- Эффект сопряжения проявляется также в том случае, если электронная пара основания находится в системе сопряжения, к примеру, с ароматической системой или двойной связью. В таком случае основания имеют более низкую силу. Например, амиды и анилины являются гораздо более слабыми основаниями, чем амины.
- Корреляция с расположением атомов в периодической системе. Чем выше электроотрицательность основного элемента, тем ниже основная сила основания. Так, сила основания понижается при движении по периоду периодической системы слева направо. Также основность понижается при переходе по группе сверху вниз, что связано с увеличением радиуса основного атома и, следовательно, меньшей плотностью отрицательного заряда на нём, что в итоге снижает силу связывания положительно заряженного протона.
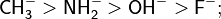
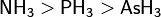
- Гибридизация. Сила органических оснований понижается, если основный атом связан с другим атомом кратными связями. Так, при переходе от аминов к иминам и нитрилам основность уменьшается. Это объясняется тем, что электронная пара в этих соединениях располагается на sp3-, sp2- и sp-гибридных орбиталях атома азота соответственно, то есть в данном ряду электронная пара приближается по характеру к s-электронам, приближаясь к атомному ядру и становясь менее доступной.