Гидроксид натрия :: Химические свойства
Гидроксид натрия · Физические свойства · Химические свойства · Качественное определение ионов натрия · Методы получения · Рынок каустической соды · Применение · Меры предосторожности при обращении с гидроксидом натрия · Литература ·
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.

Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твёрдых веществ:
- c кислотами — с образованием солей и воды:
NaOH + HCl → NaCl + H2O
(1) H2S + 2NaOH = Na2S + 2H2O (при избытке NaOH)
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
(в целом такую реакцию можно представить простым ионным уравнением, реакция протекает с выделением тепла (экзотермическая реакция): OH + H3O+ → 2H2O.)
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O
так и с растворами:
ZnO + 2NaOH(раствор) + H2O → Na2[Zn(OH)4](раствор)
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
- С амфотерными гидроксидами:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
2. Обмена с солями в растворе:
2NaOH +CuSO4 → Cu (OH)2 + Na2SO4,
2Na+ + 2OH + Cu2+ + SO42 → Cu(OH)2+ Na2SO4
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, помимо этого избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
6NaOH + Al2(SO4)3 → 2Al(OH)3 + 3Na2SO4.
6Na+ + 6OH + 2Al3+ + SO42 → 2Al(OH)3 + 3Na2SO4.
3. С неметаллами:
к примеру, с фосфором — с образованием гипофосфита натрия:
4Р + 3NaOH + 3Н2О → РН3 + 3NaH2РО2.
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
- с галогенами:
2NaOH + Cl2 → NaClO + NaCl + H2O(дисмутация хлора)
2Na+ + 2OH + 2Cl → 2Na+ + 2O2 + 2H+ + 2Cl → NaClO + NaCl + H2O
6NaOH + 3I2 → NaIO3 + 5NaI + 3H2O
4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
2Al0 + 2NaOH + 6H2O → 3H2 + 2Na[Al(OH)4]
2Al0 + 2Na+ + 8OH + 6H+ → 3H2 + 2Na+[Al3+(OH)4]
5. С эфирами, амидами и алкилгалогенидами (гидролиз):
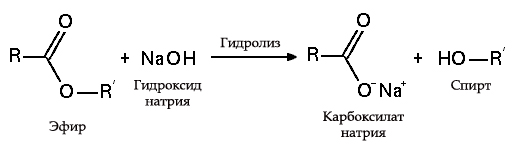
с жирами (омыление), такая реакция необратима, поскольку получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века:
(C17H35COO)3C3H5 + 3NaOH → C3H5(OH)3 + 3C17H35COONa
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, исходя из состава жира.
6. С многоатомными спиртами — с образованием алкоголятов:
HO-CH2-CH2ОН + 2NaOH → NaO-CH2-CH2-ONa + 2Н2O
7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов):
SiO2 + 4NaOH → (2Na2O)·SiO2 + 2H2O.