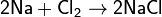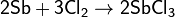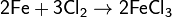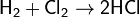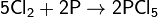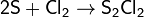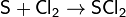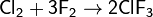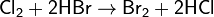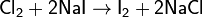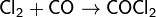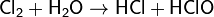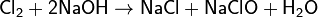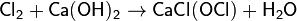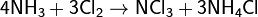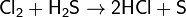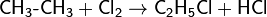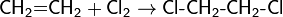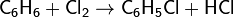Хлор :: Химические свойства
Хлор · История открытия хлора · Распространение в природе · Изотопный состав · Физические и химические свойства · Химические свойства · Способы получения · Хранение хлора · Стандарты качества хлора · Применение · Биологическая роль · Токсичность · Литература · Близкие статьи · Комментарии · Примечания · Официальный сайт ·
Строение электронной оболочки
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5, поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и прочие степени окисления. Схема образования возбуждённых состояний атома:
| Валентность | Возможные степени окисления |
Электронное состояние валентного уровня |
Пример соединений |
|---|---|---|---|
| I | +1, 1, 0 | 3s2 3p5 | NaCl, NaClO, Cl2 |
| III | +3 | 3s2 3p4 3d1 | NaClO2 |
| V | +5 | 3s2 3p3 3d2 | KClO3 |
| VII | +7 | 3s1 3p3 3d3 | KClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, к примеру ClO2 и Cl2O6. В тоже время, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Взаимодействие с металлами
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
На свету или при нагревании быстро реагирует (в некоторых случаях со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.:
или
С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O5, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
При реакции с фтором, образуется не хлорид, а фторид:
Другие свойства
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
При реакции с монооксидом углерода образуется фосген:
При растворении в воде или щелочах, хлор диспропорционирует, образуя хлорноватистую (а при нагревании хлорноватую) и соляную кислоты, либо их соли:
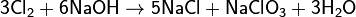 (при нагревании)
(при нагревании)
Хлорированием сухого гидроксида кальция получают хлорную известь:
Действием хлора на аммиак можно получить трихлорид азота:
Окислительные свойства хлора
Хлор — очень сильный окислитель:
Раствор хлора в воде используется для отбеливания тканей и бумаги.
Реакции с органическими веществами
С насыщенными соединениями:
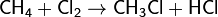 (получение хлороформа, реакция идет многоступенчато с образованием тетрахлорметана CCl4)
(получение хлороформа, реакция идет многоступенчато с образованием тетрахлорметана CCl4)
Присоединяется к ненасыщенным соединениям по кратным связям:
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (к примеру, AlCl3 или FeCl3):