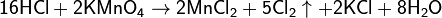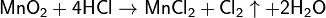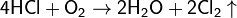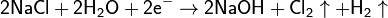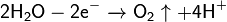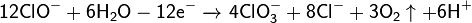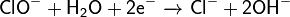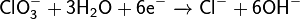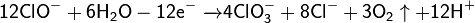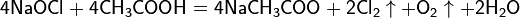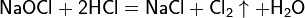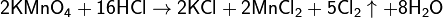Хлор :: Способы получения
Хлор · История открытия хлора · Распространение в природе · Изотопный состав · Физические и химические свойства · Химические свойства · Способы получения · Хранение хлора · Стандарты качества хлора · Применение · Биологическая роль · Токсичность · Литература · Близкие статьи · Комментарии · Примечания · Официальный сайт ·
Химические методы
Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение. Может быть получен при взаимодействии перманганата калия с соляной кислотой:
Метод Шееле
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
Метод Дикона
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона сегодня используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
Электрохимические методы
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой:
Используется три варианта электрохимического метода получения хлора. Два из них — электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). Качество хлора, получаемого электрохимическим методами, отличается мало:
| Ртутный метод | Диафрагменный метод | Мембранный метод | |
|---|---|---|---|
| Выход хлора % | 99 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
Диафрагменный метод
Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения хлора.
Раствор соли в диафрагменном электролизере непрерывно подается в анодное пространство и протекает через, обычно, насаженную на стальную катодную сетку асбестовую диафрагму, в которую в некоторых случаях добавляют небольшое количество полимерных волокон.
Насасывание диафрагмы производится путем прокачивания через электролизер пульпы из асбестовых волокон, которые, застревая в сетке катода образуют слой асбеста, играющий роль диафрагмы.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из-под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизера. Именно благодаря противоточному потоку направленному из анодного пространства в катодное через пористую диафрагму становится возможным раздельное получение щелоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH- ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO-), который, после, может окисляться на аноде до хлорат-иона ClO3-. Образование хлорат-иона серьёзно снижает выход по току хлора и является главным побочным процессом в этом методе. Так же вредит и выделение кислорода, которое, кроме того, ведет к разрушению анодов и, если они из углеродных материалов, попадания в хлор примесей фосгена.
- Анод:
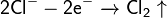 — основной процесс
— основной процесс
- Катод:
 — основной процесс
— основной процесс
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
Поваренная соль, сульфат натрия и прочие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов галита, бишофита и других минералов содержащих хлорид натрия, и кроме этого растворением их в специальных емкостях на месте производства. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения хлора по настоящее время широко используется в промышленности.
- Схема диафрагменного электролизера.
Мембранный метод
Мембранный метод производства хлора наиболее энергоэффективен, в тоже время сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из катодного пространства вытекает поток обедненного анолита, содержащего так же примеси гипохлорит- и хлорат-ионов и выходит хлор, а из анодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
В тоже время, питающий раствор соли (как свежий так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка определяется высокой стоимость полимерных катионообменных мембран и их уязвимость к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма и кроме этого низкая механическая прочность и термическая стойкость ионообменных мембран в большей части определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
- Схема мембранного электролизера.
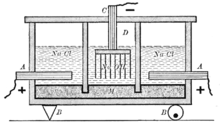
Ртутный метод с жидким катодом
В ряду электрохимических методов получения хлора ртутный метод даёт возможность получать самый чистый хлор.
- Схема ртутного электролизера.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачеваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего раствора поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
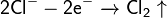 — основной процесс
— основной процесс
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения хлора с твердым катодом.
Лабораторные методы
Ввиду доступности хлора в лабораторной практике обычно используется сжиженный хлор в баллонах. Хлор можно получить действием кислоты на гипохлорит натрия:
Помимо этого также выделяется кислород. Если использовать соляную кислоту, то реакция выглядит по-другому:
Для получения хлора в небольших количествах как правило используются процессы, основанные на окислении хлороводорода сильными окислителями (к примеру, оксидом марганца (IV), перманганатом калия, дихроматом калия, диоксид свинца, бертолетова соль и т. п.), обычно использовался диоксид марганца или перманганат калия:
При невозможности использования баллонов могут быть использованы небольшие электролизеры с обычным или вентильным электродом для получения хлора.