Дофамин :: Нейромедиатор
Дофамин · Нейромедиатор · Гормон · Патологии · Процесс старения · Близкие статьи · Примечания · Литература · Официальный сайт ·
Дофамин является одним из химических факторов внутреннего подкрепления (ФВП) и служит важной частью «системы поощрения» мозга, поскольку вызывает чувство удовольствия (или удовлетворения), чем влияет на процессы мотивации и обучения. Дофамин естественным образом вырабатывается в больших количествах во время позитивного, по субъективному представлению человека, опыта — к примеру, секса, приёма вкусной пищи, приятных телесных ощущений, и кроме этого наркотиков. Нейробиологические эксперименты показали, что даже воспоминания о позитивном поощрении могут увеличить уровень дофамина, поэтому этот нейромедиатор используется мозгом для оценки и мотивации, закрепляя важные для выживания и продолжения рода действия.
Дофамин играет немаловажную роль в обеспечении когнитивной деятельности. Активация дофаминергической передачи необходима при процессах переключения внимания человека с одного этапа когнитивной деятельности на другой. Таким образом, недостаточность дофаминергической передачи приводит к повышенной инертности больного, которая клинически проявляется замедленностью когнитивных процессов (брадифрения) и персеверациями. Данные нарушения являются наиболее типичными когнитивными симптомами болезней с дофаминергической недостаточностью — к примеру, болезни Паркинсона.
Как и у большинства нейромедиаторов, у дофамина существуют синтетические аналоги, и кроме этого стимуляторы его выделения в мозге. В частности, многие наркотики увеличивают выработку и высвобождение дофамина в мозге в 5—10 раз, что даёт возможность людям, которые их употребляют, получать чувство удовольствия искусственным образом. Так, амфетамин напрямую стимулирует выброс дофамина, воздействуя на механизм его транспортировки. Другие наркотики, к примеру, кокаин и некоторые другие психостимуляторы, блокируют естественные механизмы обратного захвата дофамина, увеличивая его концентрацию в синаптическом пространстве. Морфий и никотин имитируют действие натуральных нейромедиаторов, а алкоголь блокирует действие антагонистов дофамина. Если пациент продолжает перестимулировать свою «систему поощрения», медленно мозг адаптируется к искусственно повышаемому уровню дофамина, производя меньше гормона и снижая количество рецепторов в «системе поощрения», один из факторов побуждающих наркомана увеличивать дозу для получения прежнего эффекта. Дальнейшее развитие химической толерантности может медленно привести к метаболическим нарушениям в головном мозге, а в долговременной перспективе потенциально нанести серьёзный ущерб здоровью мозга.
Для лечения болезни Паркинсона асто используют агонисты дофаминовых рецепторов (прамипексол, бромокриптин, перголид и др.): на сегодняшний день это самая многочисленная группа противопаркинсонических средств. Некоторые из антидепрессантов также обладают дофаминергической активностью.
Существуют и лекарственные препараты, блокирующие дофаминергическую передачу, например такие антипсихотические средства, как аминазин, галоперидол, рисперидон, клозапин и др. Резерпин блокирует накачку дофамина в пресинаптические везикулы.
При таких психических заболеваниях, как шизофрения и обсессивно-компульсивное расстройство, отмечается повышенная дофаминергическая активность в некоторых структурах мозга, в частности в лимбическом пути (при шизофрении отмечается вдобавок пониженная активность дофамина в мезокортикальном дофаминовом пути и префронтальной коре), а паркинсонизм связан с пониженным содержанием дофамина в нигростриарном пути. Со снижением уровня дофамина в подкорковых образованиях и передних отделах головного мозга связывают также процесс нормального старения.
Биосинтез
Предшественником дофамина является L-тирозин (он синтезируется из фенилаланина), который гидроксилируется ферментом тирозингидроксилазой с образованием L-ДОФА, которая, в свою очередь, декарбоксилируется с помощью фермента L-ДОФА-декарбоксилазы и превращается в дофамин. Этот процесс происходит в цитоплазме нейрона.
Рецепторы
Постсинаптические дофаминовые рецепторы относятся к семейству GPCR. Существует по меньшей мере пять различных подтипов дофаминовых рецепторов — D1—5. Рецепторы D1 и D5 обладают довольно значительной гомологией и сопряжены с белком GS, который стимулирует аденилатциклазу, вследствие чего их обычно рассматривают совместно как D-1-подобные рецепторы. Остальные рецепторы подсемейства подобны D2 и сопряжены с Gi-белком, который ингибирует аденилатциклазу, вследствие чего их объединяют под общим названием D-2-подобные рецепторы. Таким образом, дофаминовые рецепторы играют роль модуляторов долговременной потенциации.
Участие во «внутреннем подкреплении» принимают D2 и D4 рецепторы.
В больших концентрациях дофамин также стимулирует - и -адренорецепторы. Влияние на адренорецепторы связано не столько с прямой стимуляцией адренорецепторов, сколько со способностью дофамина высвобождать норадреналин из гранулярных пресинаптических депо, то есть оказывать непрямое адреномиметическое действие.
«Круговорот» дофамина
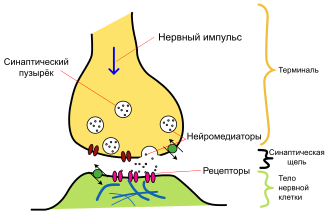
Синтезированный нейроном дофамин накапливается в дофаминовых везикулах (т. н. «синаптическом пузырьке»). Этот процесс является протон-сопряжённым транспортом. В везикулу с помощью протон-зависимой АТФазы закачиваются ионы H+. При выходе протонов по градиенту в везикулу поступают молекулы дофамина.
Далее дофамин выводится в синаптическую щель. Часть его участвует в передаче нервного импульса, воздействуя на клеточные D-рецепторы постсинаптической мембраны, а часть возвращается в пресинаптический нейрон с помощью обратного захвата. Ауторегуляция выхода дофамина обеспечивается D2 и D3 рецепторами на мембране пресинаптического нейрона. Обратный захват производится транспортером дофамина. Вернувшийся в клетку медиатор расщепляется с помощью моноаминооксидазы (МАО) и, далее, альдегиддегидрогеназы и катехол-О-метил-трансферазы до гомованилиновой кислоты.
Участие в системе поощрения

В фундаментальном исследовании 1954 года канадские учёные Джеймс Олдс и его коллега Питер Милнер обнаружили, что если имплантировать электроды в определённые участки мозга, особенно в средний узел переднего мозга, то крысу можно приучить нажимать рычаг в клетке, включающий стимуляцию низковольтными разрядами электричества. Когда крысы научились стимулировать этот участок, они нажимали рычаг до тысячи раз в час. Это дало основание предположить, что стимулируется центр наслаждения. Один из главных путей передачи нервных импульсов в этом участке мозга — дофаминовый, поэтому исследователи выдвинули версию, что главное химическое вещество, связанное с удовольствием, — это дофамин. Далее это предположение было подтверждено радионуклидными томографическими сканерами и открытием антипсихотиков (лекарственных средств, подавляющих продуктивные симптомы шизофрении).
В тоже время в 1997 году было показано, что дофамин играет более тонкую роль. В эксперименте Шульца у обезьяны создавали условный рефлекс по классической схеме Павлова: после светового сигнала в рот обезьяне впрыскивали сок. Было установлено, что:
- Когда сок впрыскивали неожиданно (не предваряя его сигналом), активность дофаминовых нейронов увеличивалась.
- На этапе обучения активность дофаминовых нейронов увеличивалась по-прежнему в ответ на впрыскивание сока.
- Когда условный рефлекс был сформирован, активность дофаминовых нейронов увеличивалась после подачи сигнала (до впрыскивания сока). Само впрыскивание сока на активности этих нейронов больше не отражалось (что противоречит гипотезе, согласно которой дофамин связан просто с получением удовольствия).
- Если в момент, когда ожидалось получение сока, сок не впрыскивали, активность дофаминовых нейронов снижалась.
Это позволило предположить, что дофамин участвует в формировании и закреплении условных рефлексов при положительном подкреплении и в гашении их, если подкрепление прекращается. Другими словами, если наше ожидание награды оправдывается, мозг сообщает нам об этом выработкой дофамина. Если же награда не воспоследовала, снижение уровня дофамина сигнализирует, что модель разошлась с реальностью. В дальнейших работах показано, что активность дофаминовых нейронов хорошо описывается известной моделью обучения автоматов: действиям, быстрее приводящим к получению награды, приписывается большая ценность. Таким образом происходит обучение методом проб и ошибок.
Дофаминергическая система
Из всех нейронов ЦНС только около семи тысяч вырабатывают дофамин. Известно несколько дофаминовых ядер, расположенных в мозге. Это дугообразное ядро (латынь nucleus arcuatum), дающее свои отростки в срединное возвышение гипоталамуса. Дофаминовые нейроны чёрной субстанции посылают аксоны в стриатум (хвостатое и чечевицеобразное ядро). Нейроны, находящиеся в области вентральной покрышки, дают проекции к лимбическим структурам и коре.
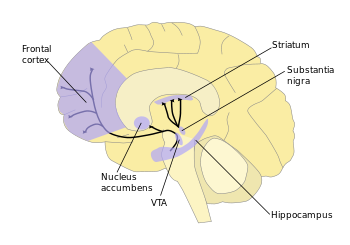
Основными дофаминовыми путями являются:
- мезокортикальный путь (процессы мотивации и эмоциональные реакции)
- мезолимбический путь (продуцирование чувств удовольствия, ощущения награды и желания)
- нигростриарный путь (двигательная активность, экстрапирамидная система)
Тела нейронов нигростриатного, мезокортикального и мезолимбического трактов образуют комплекс нейронов чёрной субстанции и вентрального поля покрышки. Аксоны этих нейронов идут вначале в составе одного крупного тракта (медиального пучка переднего мозга), а далее расходятся в различные мозговые структуры. Некоторые авторы объединяют мезокортикальную и мезолимбическую подсистемы в единую систему, в тоже время более обоснованно выделение мезокортикальной и мезолимбической подсистем следовательно проекциям в лобную кору и лимбические структуры мозга.
В экстрапирамидной системе дофамин играет роль стимулирующего нейромедиатора, способствующего повышению двигательной активности, уменьшению двигательной заторможенности и скованности, снижению гипертонуса мышц. Физиологическими антагонистами дофамина в экстрапирамидной системе являются ацетилхолин и ГАМК.
Другие подсистемы
Выделяют также тубероинфундибулярный путь (лимбическая система — гипоталамус — гипофиз), инцертогипоталамический, диенцефалоспинальный и ретинальный (в некоторых случаях, вдобавок к этому, перивентрикулярную и ольфакторную системы). Данная дифференциация не является абсолютной, поскольку проекции дофаминергических нейронов разных трактов «перекрываются»; кроме того, в мозге отмечается и диффузное распределение дофаминергических элементов (отдельных клеток с отростками).
В гипоталамусе и гипофизе дофамин играет роль естественного тормозного нейромедиатора, угнетающего секрецию ряда гормонов. Помимо этого угнетающее действие на секрецию разных гормонов реализуется при разных концентрациях дофамина, что обеспечивает высокую специфичность регуляции. Наиболее чувствительна к тормозящему действию дофаминергических сигналов секреция пролактина, в меньшей степени — секреция соматолиберина и соматотропина, в ещё меньшей — секреция кортиколиберина и кортикотропина и в совсем малой степени — секреция тиролиберина и тиротропина. Секреция гонадотропинов и гонадолиберина не угнетается дофаминергическими сигналами.
Ввиду чувствительности некоторых гормональных подсистем к уровню дофамина препараты-дофаминомиметики, усиливающие его синтез, могут применяться в качестве терапии при гормональных заболеваниях. К примеру, дофаминомиметики назначают при гиперпролактинемии и при болезни Паркинсона.
Дофамин и прочие нейромедиаторы
Дофаминергические подсистемы находятся под контролем или сами контролируют норадренергические, серотонинергические, ГАМК-ергические, холинергические, мелатонинергические, глутаматергические, пептидергические системы. ГАМК-ергические и серотонинергические системы находятся в антагонистических отношениях с дофаминергической системой, а норадренергическая и дофаминергическая системы в разных функциональных состояниях функционируют однонаправленно: как в период бодрствования, так и в период сна. Взаимодействия дофаминергической и холинергической системы сложны, в условиях патологических процессов активность этих систем неоднозначна.