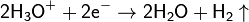Водород :: Получение
Водород · История · Происхождение названия · Распространённость · Получение · Физические свойства · Изотопы · Свойства изотопов · Химические свойства · Геохимия водорода · Меры предосторожности · Экономика · Применение · Интересные факты · Близкие статьи · Комментарии · Примечания · Литература ·
Подробнее: Производство водорода
Есть другая статья: Биотехнологическое получение водорода
В промышленности
- Конверсия с водяным паром при 1000 °C:
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
- Электролиз водных растворов солей:
- Каталитическое окисление кислородом:
- Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
- Действие разбавленных кислот на металлы. Для проведения такой реакции зачастую используют цинк и разбавленную серную кислоту:
- Взаимодействие кальция с водой:
- Гидролиз гидридов:
- Действие щелочей на цинк или алюминий:
- С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, к примеру:
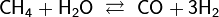
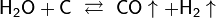
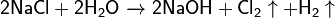
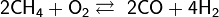
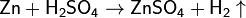
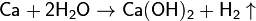
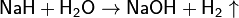
![{\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na[Al(OH)_{4}]+3H_{2}\uparrow }}](../i/w/5be90d7490aac370d9837e83e3067d2a.png)
![{\mathsf {Zn+2KOH+2H_{2}O\rightarrow K_{2}[Zn(OH)_{4}]+H_{2}\uparrow }}](../i/w/b979c07b20d6f36bcfd32fbff37d637e.png)