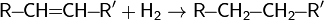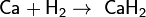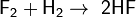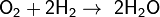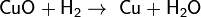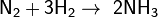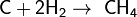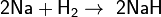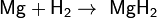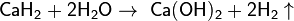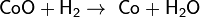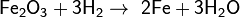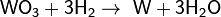Водород :: Химические свойства
Водород · История · Происхождение названия · Распространённость · Получение · Физические свойства · Изотопы · Свойства изотопов · Химические свойства · Геохимия водорода · Меры предосторожности · Экономика · Применение · Интересные факты · Близкие статьи · Комментарии · Примечания · Литература ·
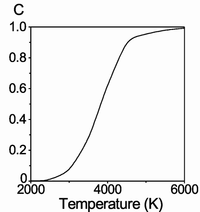
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
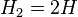 - 432 кДж
- 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, к примеру с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, к примеру при освещении:
Он может «отнимать» кислород от некоторых оксидов, например:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
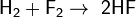 , реакция протекает со взрывом в темноте и при любой температуре,
, реакция протекает со взрывом в темноте и при любой температуре,
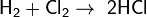 , реакция протекает со взрывом, только на свету.
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов (обычно, d-элементов)
Оксиды восстанавливаются до металлов:
Гидрирование органических соединений
Молекулярный водород широко используется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.