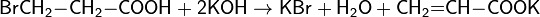Карбоновые кислоты :: Получение
Карбоновые кислоты · Номенклатура · Классификация · История открытия · Нахождение в природе · Получение · Физические свойства · Строение · Сила · Карбоновые кислотные остатки · Характерные химические реакции и получение важных производных · Химические методы анализа карбоновых кислот · Спектральные методы анализа карбоновых кислот · Применение · Литература · Официальный сайт · Примечания · Близкие статьи ·
Лабораторные методы получения предельных кислот
Окислительные методы
- Окисление спиртов (реактивом Джонса - раствором оксида хрома(VI) в разбавленной серной кислоте и ацетоне или перманганатом калия в кислой или нейтральной среде):
![{\mathsf {RCH_{2}OH+[O]\longrightarrow \ RCOOH}}](../i/w/4797cb6951cd966eded7ea975bc93750.png)
- Окисление альдегидов (используюбтся те же реагенты, что и в случае спиртов, и кроме этого оксид серебра(I)):
![{\mathsf {RCHO+[O]\longrightarrow \ RCOOH}}](../i/w/6c6dfc55ce17e8cf404dc5aa1bbba4bc.png)
- Окисление алкинов соединениями Tl (III):
![{\mathsf {RCCH{\xrightarrow[ {Tl(NO_{3})_{3}}]{}}RCOOH}}](../i/w/0cbc11142b2b8198b191779c108fc4b1.png)
- Окислительная деструкция алкенов - окисление алкенов смесью перманганата калия и периодата натрия в водном ацетоне в нейтральной среде (реакция идёт в две стадии - на первой перманганат окисляет алкен до диола, на второй периодат окисляет диол до кислоты, избыток периодата окисляет Mn+4 до Mn+7, так что перманганата требуется лишь каталитическое количество):
![{\mathsf {R^{1}CH{=}CHR^{2}{\xrightarrow[ {KMnO_{4},NaIO_{4}}]{}}R^{1}COOH+R^{2}COOH}}](../i/w/947e58ad7bf55c991c3c11aef1883acb.png)
- Окисление алкилбензолов и других алкиларенов - самый распространённый способ получения ароматических карбоновых кислот. Помимо этого первичные и вторичные алкильные группы окисляются до карбоксильной. В качестве окислителя применяются водный щелочный, нейтральный или солюбилизированный краун-6-эфиром в безоле (пурпурный бензол) растворы перманганата калия, кислый бихромата натрия или водная азотная кислота:
![{\mathsf {C_{6}H_{5}CH_{3}{\xrightarrow[ {KMnO_{4}}]{}}C_{6}H_{5}COOH}}](../i/w/e913781dda1d329a1d6585aa77bc6d82.png)
Гидролиз
- Гидролиз тригалогеналканов
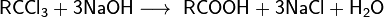
- Гидролиз сложных эфиров
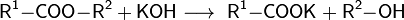
- Гидролиз нитрилов и амидов
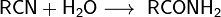
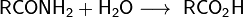
Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу (амид легко гидролизируется в присутствии H2O2 в щелочной среде или нитрит-иона в кислой); удобный лабораторный метод (если нитрил доступен).
Карбоксилирование
- Карбоксилирование металлорганических соединений (в основном реактивов Гриньяра и литийорганических соединений):
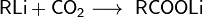
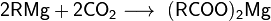
- Карбоксилирование илидов фософора:
![{\mathsf {RR'C{=}PPh_{3}{\xrightarrow[ {CO_{2}}]{}}RR'CHCOOH}}](../i/w/7be69ef90db2eef0c6dfe302a434137d.png)
- При помощи диизопропиламида лития и других аналогичных амидов можно непосредственно вводить группу -CH2COOH:
![{\mathsf {CH_{3}COOH{\xrightarrow[ {LiN(CH(CH_{3})_{2})_{2}}]{}}^{{-}}{}CH_{2}COO^{{-}}{}{\xrightarrow[ {RHal}]{}}RCH_{2}COOH}}](../i/w/2ba196410aea838ac386794add13f830.png)
Синтез ароматических кислот
Имеется несколько специфических методов применяемых только для синтеза ароматических кислот.
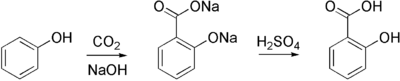
- Реакция Кольбе-Шмитта - карбоксилирование фенолятов металлов (в промышленности эта реакции используется для синтеза салициловой кислоты):
- Реакция Фриделя-Крафтса с использованием фосгена.
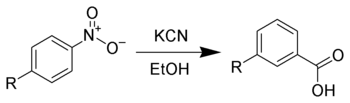
- Реакция Фон-Рихтера - ароматическое нитросоединение при реакции с цианидом калия карбоксилируется в орто положении к нитрогруппе:
Другие методы
- Реакция Арндта-Эйстерта - превращение карбоновой кислоты в ближайший гомолог с использованием диазометана:
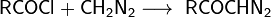
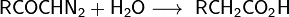
Используется для получения высших гомологов кислот из низших.
- Серия реакций для превращения в низший гомолог:
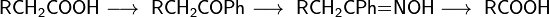
В промышленности
- Окисление парафиновых углеводородов воздухом или техническим кислородом при высокой температуре в присутствии или в отстутствие катализаторов. Низшие углеводороды (с числом атомов углерода до 8) окисляются главным образом в паровой фазе при повышенном давлении, а высшие (от 16 до 30 атомов карбона для получения кислот от 10 до 20 атомов карбона) - преимущественно в жидкой фазе. Окисление проводят при температуре около 500 °C и атмосферном давлении или при 400 °C под давлением 10-20 МПа (130-200 атмосфер). Катализаторами служат металлы, их оксиды и соли. При получении высших жирных кислот в присутствии катализаторов температуру снижают до 130-150 °C. При окислении углеводородов обычно образуется смесь кислот с различным количеством углеродных атомов.
- Оксосинтез:
а. получают альдегиды и окисляют до соответствующих кислот.
б. получают спирты, а после сплавляют их при 250-350 °C с щелочью:
![{\mathsf {RCH_{2}OH{\xrightarrow[ {NaOH}]{}}RCOOH+2H_{2}}}](../i/w/9e2f1f53afe9c5c7014296498576a400.png)
в. взаимодействие олефинов с оксидом углерода (II) и водяным паром в присутствии тетракарбонила никеля или фосфорной кислоты при температуре 300-400 °C и давлении 200-500 атмосфер получают смесь кислот нормального и изостроения, к примеру: 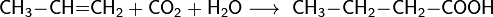
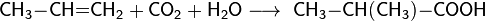
Получение непредельных кислот
- 1.Введение карбоксильной группы в олефин:
- 2. Исходят из предельной кислоты и переводят её в ненасыщенную:
![{\mathsf {CH_{2}{=}CHCH_{3}+Cl_{2}{\xrightarrow[ {}]{450C,-HCl}}CH_{2}{=}CHCH_{2}Cl{\xrightarrow[ {}]{+KCN,-KCl}}CH_{2}{-}CHCH_{2}CN{\xrightarrow[ {}]{+H_{2}O,-NH_{3}}}CH_{2}CHCH_{2}COOH}}](../i/w/44913079f1dd6c16bdc1cd0c3e63fcb4.png)