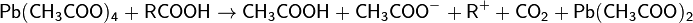Карбоновые кислоты :: Характерные химические реакции и получение важных производных
Карбоновые кислоты · Номенклатура · Классификация · История открытия · Нахождение в природе · Получение · Физические свойства · Строение · Сила · Карбоновые кислотные остатки · Характерные химические реакции и получение важных производных · Химические методы анализа карбоновых кислот · Спектральные методы анализа карбоновых кислот · Применение · Литература · Официальный сайт · Примечания · Близкие статьи ·
Кислотные свойства
Карбоновые кислоты проявляют типичные кислотные свойства - при реакции с металлами, их оксидами или их основными гидроксидами дают соли соответствующих металлов, могут вытеснять более слабую кислоту из её соли и сами могут быть вытеснены более сильной кислотой:
Соли карбоновых кислот в воде подвергаются гидролизу и имеют щелочную реакцию.
Восстановление
Карбоновые кислоты восстанавливаются до первичных спиртов с помощью литийалюминийгидрида при кипячении в тетрагидрофуране или дибораном в более мягких условиях, кроме того помимо этого не восстанавливаются группы NO2, COOR и CN:
Избирательное восстановление до альдегидов достигается обработкой Li в метиламине (образующийся альдегид защищается растворителем в виде азометина):
Галогенирование
Радикальное галогенирование кислот хлором при облучении УФ-светом при 300-400 °C идёт неселективно и приводит к трудноразделяемой смеси изомеров. Региоселективное -галгенирование достигается по методу Гелль-Фольгарда-Зелинского - кислоту обрабатывают хлором или бромом в присутствии красного фосфора или соответствующих хлорида или бромида фосфора(III).
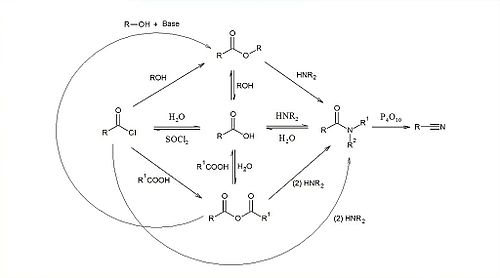
Реакции нуклеофильного замещения у ацильного атома углерода
Подробнее: Реакции нуклеофильного замещения
Для реакций нуклеофильного замещения у sp2-гибридного ацильного атома углерода реализируется двухстадийный механизм присоединения-отщепления. В первой стадии нуклеофильный агент присоединяется к карбоновой кислоте (или её производному) с образованием заряженного (для анионного нуклеофильного агента) или незаряженного (для нейтрального) тетраэдрического интермедианта. Во второй стадии от этого интермедианта отщепляется в виде аниона или нейтральной молекулы уходящая группа Z и образуется конечный продукт присоединения. Реакция обратима, в тоже время если Z- и Nu- сильно различаются по своей основности и нуклеофильности, она становится необратимой.
- Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
Выделение воды идёт за счёт гидроксила карбоксильной группы кислоты и атома водорода гидроксила спирта. В то же время при применении кислоты, меченной 18O по карбонилу наблюдалась потеря активности. Это свидетельствует о том, что в реакции затрагивается и карбонильный атом кислорода.
- Реакция с литийорганическими соединениями - важный метод получения кетонов:
![{\mathsf {RCOOH{\xrightarrow[ {R'Li}]{}}RCOOLi{\xrightarrow[ {R'Li}]{}}R{-}C(O){-}R'}}](../i/w/d06f9b76b442805886e4e05a066ec847.png) '
'
- С магнийорганическими соединениями карбоновые кислоты реагируют только в жёстких условиях образуя, обычно, третичные спирты.
- Под действием SOCl2 и PCl5 карбоновые кислоты превращаются в соответствующие хлорангидриды:
- Ангидриды можно получить дегидратацией кислот, в тоже время этот метод применим не ко всем кислотам (так в основном получают лишь ангидриды сильных карбоновых кислот). Их получают в основном реакцией галогенангидридов с солями карбоновых кислот. Таким образом получают и смешанные ангидриды:
Двухосновные янтарная и глутаровая кислоты при нагревании легко превращаются во внутренние ангидриды.
Кетены являются внутренними ангидридами кислот. Их получают в основном элиминированием хлорангидридов кислот. Кетен можно получить пиролизом уксусной кислоты и уксусного ангидрида.
Получение амидов и нитрилов
При нагревании аммонийных солей карбоновых кислот образуются их амиды:
При нагревании амидов с P2O5 отщепляется вода и образуются нитрилы кислот:
Декарбоксилирование
Реакция Бородина-Хунсдиккера - серебряная соль карбоновой кислоты при нагревании с раствором брома в CCl4 превращается в алкилгалогенид:
При окислении-декарбоксилировании тетраацетатом свинца исходя из условий образуются алканы, алкены или эфиры уксусной кислоты:
Карбокатион, отщепляя протон превращается в алкен, а захватывая ацет-анион - в эфир.
Реакция Кольбе - электрохимическая реакция получения углеводородов из карбоновых кислот:
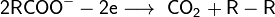
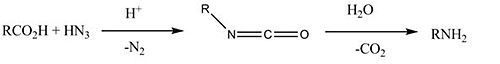
Реакция Шмидта - при реакции с азотистоводородной кислотой образуются амины (промежуточным продуктом является изоцианат) и выделяется углекислый газ:
При нагревании в присутствии в присутствии гидроксида бария карбоновые кислоты (и кроме этого их кальциевые и бариевые соли) декарбоксилируются с образованием симметрических кетонов. Именно эта реакция долгое время была главным способом получения ацетона:
![{\mathsf {Ca(CH_{3}COO)_{2}{\xrightarrow[ {t}]{}}CaCO_{3}+CO_{2}\uparrow +(CH_{3})_{2}CO}}](../i/w/a8149c8ca1c748d00b05c8da188acbe5.png)
Примером внутримолекулярной реакции данного типа является получение циклопентанона пиролизом адипиновой кислоты и циклогексанона пиролизом пимелиновой кислоты в присутствии солей бария или кальция (циклизация Ружички).
Простейшие двухосновные кислоты (щавелевая и малоновая) термически неустойчивы и легко декарбоксилируются:
![{\mathsf {HOOC-COOH{\xrightarrow[ {t}]{}}HCOOH+CO_{2}}}](../i/w/5b25bd8cd62f62285b56aceaf1a84c99.png)
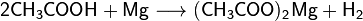
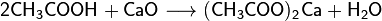
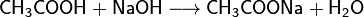
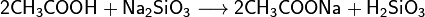
![{\mathsf {CH_{3}(CH_{2})_{4}COOH{\xrightarrow[ {B_{2}H_{4},H^{{+}}}]{}}CH_{3}(CH_{2})_{4}CH_{2}OH}}](../i/w/a88ad74ff3b76d455c6e0b0344776eb0.png)
![{\mathsf {RCOOH{\xrightarrow[ {Li,CH_{3}NH_{2}}]{}}RCH{=}NCH_{3}{\xrightarrow[ {H_{3}O^{{+}}}]{}}RCHO}}](../i/w/b7c3b9f4c3422d92b699334e95ff448d.png)
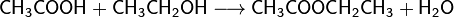
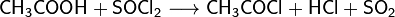

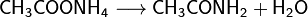
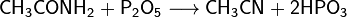
![{\mathsf {RCOOAg+Br_{2}{\xrightarrow[ {CCl_{4}}]{}}RBr+CO_{2}+AgBr}}](../i/w/e9c754da4c6ec3c4ea2f1bbada39f769.png)