Бензилпенициллин :: Получение
Бензилпенициллин · Исторические сведения · Фармакологическое действие · Фармакокинетика · Показания · Побочное действие · Противопоказания · Беременность и лактация · Особые указания · Синонимы бензилпенициллина · Лекарственное взаимодействие · Получение · Примечания · Официальный сайт ·
Биосинтез
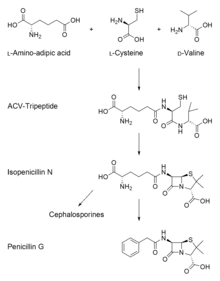
Биосинтез пенициллина осуществляется в три стадии:
- На первой стадии происходит конденсация трех аминокислот: L--аминоадиповой кислоты, L-цистеина, L-валина в трипептид. Перед конденсацией в трипептид аминокислота L-валин превращается D-валин. Указанный трипептид называют -(L--аминоадипил)-L-цистеин-D-валин (англ. ACV). Реакции конденсации и эпимеризации катализируются ферментов -(L--аминоадипил)-L-цистеин-D-валин синтетазой (англ. ACVS), синтетазой нерибосомных пептидов (англ. NRPS).
- Вторая стадия биосинтеза пенициллина это окисление линейной молекулы ACV в двуциклический интермедиат изопенициллин N ферментов изопенициилин N синтетазой (англ. IPNS), продуктом гена pcbC. Изопенициллин N — очень слабый интермедиат, поскольку он не обладает противомикробной активностью.
- На заключительной стадии происходит трансаминирование ферментом изопенициллин N N-ацилтрансферазой, помимо этого -аминоадипиловая боковая цепь изопенициллина N удаляется и заменяется на фенилуксусную кислоту. Фермент, катализирующий эту реакцию является продуктом гена penDE.
Полный синтез
Химик Джон Шиэн (англ. Sheehan) в Массачусетском технологическом институте (англ. MIT) в 1957 году осуществил полный химический синтез пенициллина. Шиэн приступил к изучению синтеза пенициллинов в 1948 году и в ходе исследований разработал новые методы синтеза пептидов, и кроме этого новые защитные группы. Не смотря на то, что метод синтеза, разработанный Шиэном не был пригоден для массового производства пенициллинов, один из интермедиатов в синтезе (6-аминопенициллановая кислота, англ. 6-APA) является ядром молекулы пенициллина. Присоединение разных групп к ядру 6-APA позволило получить новые формы пенициллинов.
Производные
Выделение ядра молекулы пенициллина 6-APA, позволило получить новые полусинтетические антибиотики, обладающие лучшими свойствами, чем бензилпенициллин (биодоступность, спектр убиваемых микроорганизмов, стабильность).
Первым важным полученным производным был ампициллин, который обладал более широким спектром антибактериальной активности, чем исходные препараты антибиотиков. Дальнейшие исследования позволили получить устойчивые к -лактамазе антибиотики, в том числе, флуклоксациллин, диклоксациллин и метициллин. Эти антибиотики были эффективны против бактерий, синтезирующих бета-лактамазу, в тоже время, неэффективны против устойчивого к метициллину золотистого стафиллококка (англ. MRSA), возникшего немного позднее.