Ферменты :: Структура и механизм действия ферментов
Ферменты · История изучения · Функции ферментов · Классификация ферментов · Соглашения о наименовании ферментов · Кинетические исследования · Структура и механизм действия ферментов · Множественные формы ферментов · Медицинское значение · Практическое использование · Примечания · Литература ·
Активность ферментов определяется их трёхмерной структурой.
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
Активный центр ферментов
Изучение механизма химической реакции, катализируемой ферментом наряду с определением промежуточных и конечных продуктов на разных стадиях реакции подразумевает точное знание геометрии третичной структуры фермента, природы функциональных групп его молекулы, обеспечивающих специфичность действия и высокую каталитическую активность на этот субстрат, и кроме этого химической природы участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Обычно молекулы субстрата, участвующие в ферментативных реакциях, по сравнению с молекулами ферментов имеют относительно небольшие размеры. Таким образом, при образовании фермент-субстратных комплексов в непосредственное химическое взаимодействие вступают лишь ограниченные фрагменты аминокислотной последовательности полипептидной цепи — «активный центр» — уникальная комбинация остатков аминокислот в молекуле фермента, обеспечивающая непосредственное взаимодействие с молекулой субстрата и прямое участие в акте катализа.
В активном центре условно выделяют:
- каталитический центр — непосредственно химически взаимодействующий с субстратом;
- связывающий центр (контактная или «якорная» площадка) — обеспечивающий специфическое сродство к субстрату и формирование комплекса фермент-субстрат.
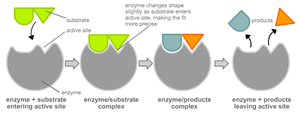
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
Фермент, соединяясь с субстратом:
- очищает субстрат от водяной «шубы»
- располагает реагирующие молекулы субстратов в пространстве нужным для протекания реакции образом
- подготавливает к реакции (к примеру, поляризует) молекулы субстратов.
Обычно присоединение фермента к субстрату происходит за счет ионных или водородных связей, редко — за счет ковалентных. В конце реакции её продукт (или продукты) отделяются от фермента.
В результате фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (по факту происходит другая реакция), к примеру:
В отсутствие фермента:
- А+В = АВ
В присутствии фермента:
- А+Ф = АФ
- АФ+В = АВФ
- АВФ = АВ+Ф
где А, В — субстраты, АВ — продукт реакции, Ф — фермент.
Ферменты не могут самостоятельно обеспечивать энергией эндергонические реакции (для протекания которых требуется энергия). Поэтому ферменты, осуществляющие такие реакции, сопрягают их с экзергоническими реакциями, идущими с выделением большего количества энергии. К примеру, реакции синтеза биополимеров зачастую сопрягаются с реакцией гидролиза АТФ.
Для активных центров некоторых ферментов характерно явление кооперативности.
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
Модель «ключ-замок»
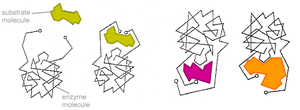
В 1890 г. Эмиль Фишер предположил, что специфичность ферментов определяется точным соответствием формы фермента и субстрата. Такое предположение называется моделью «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. В тоже время, не смотря на то, что эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике.
Модель индуцированного соответствия
В 1958 г. Дениел Кошланд предложил модификацию модели «ключ-замок». Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое даёт возможность ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».
Модификации
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность в полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации — присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой. Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Ещё один распространенный тип посттранляционных модификаций — расщепление полипептидной цепи. Например, химотрипсин (протеаза, участвующая в пищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется в поджелудочной железе. Неактивная форма транспортируется в желудок, где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большая часть кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.
Регуляция работы ферментов
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Ингибирование конечным продуктом
Метаболический путь — цепочка последовательных ферментативных реакций. Зачастую конечный продукт метаболического пути является ингибитором фермента, ускоряющего первую из реакций данного метаболического пути. Если конечного продукта слишком много, то он действует как ингибитор для самого первого фермента, а если после этого конечного продукта стало слишком мало, то первый фермент опять активируется. Таким образом, ингибирование конечным продуктом по принципу отрицательной обратной связи — важный способ поддержания гомеостаза (относительного постоянства условий внутренней среды организма).
Влияние условий среды на активность ферментов
Активность ферментов зависит от условий в клетке или организме — давления, кислотности среды, температуры, концентрации растворённых солей (ионной силы раствора) и др.